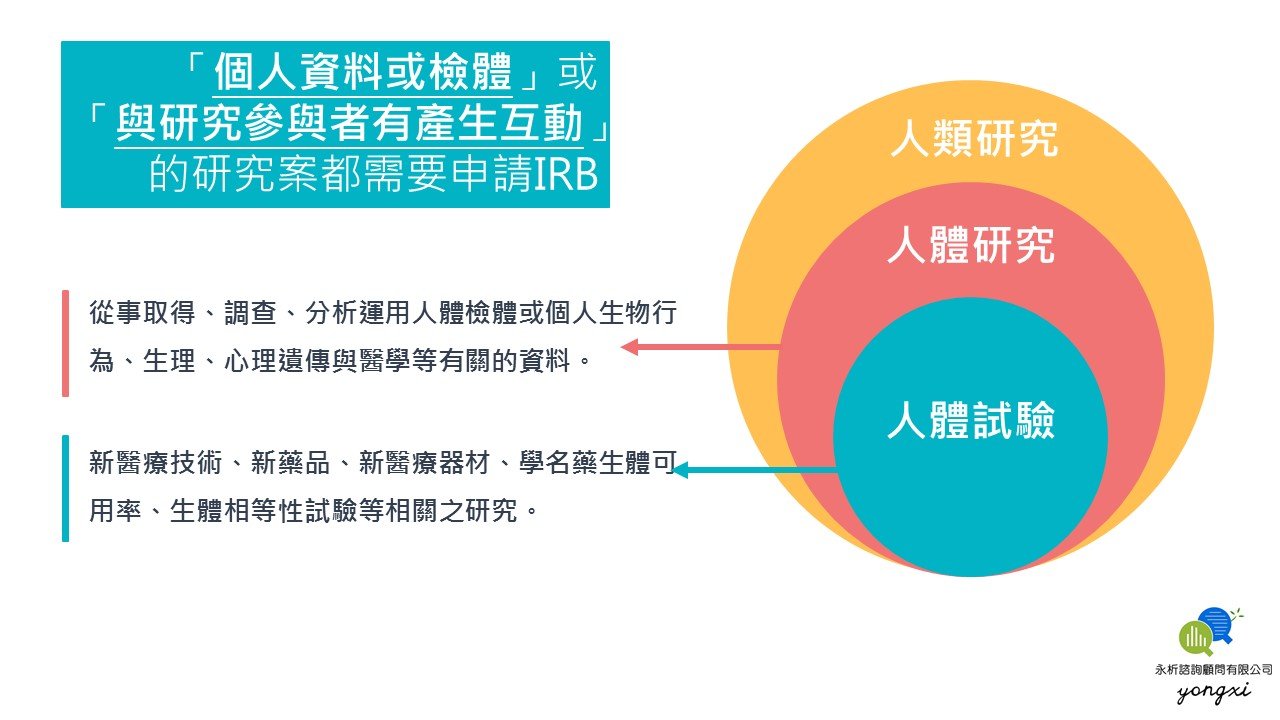
研究案內容若屬「個人資料或檢體」或「與研究參與者有產生互動」的研究案都需要向人類研究倫理審查委員會(Institutional Review Board, IRB)申請審查,經審查通過後,方才得以開始執行研究計畫案。
臺灣政府在100年12月28日公告施行「人體研究法」,該法案的成立是基於尊重、善意以及正義之原則,保護接受研究調查或試驗參與者的權益,所以現在若欲申請科技部研究計畫案,也都需要繳交申請IRB的送審證明。
關於人體研究可根據研究涉及收案的資料分為
1、人體研究:從事取得、調查、分析運用人體檢體或個人生物行為、生理、心理遺傳與醫學等有關的資料,通常執行單位為學校、研究單位,可向教育部核查合格名單申請IRB,目前經過教育部審查通過的人體研究倫理審查會查核合格名單共計有13個,如圖所示。
2、人體試驗:新醫療技術、新藥品、新醫療器材、學名藥生體可用率、生體相等性試驗等相關之研究,通常執行單位為醫院,可向衛生福利部核查合格名單申請IRB,目前經過衛生福利部審查通過的人體研究倫理審查會查核合格名單共計有28個,如圖所示。




溫馨小提醒:
- 若您所屬的組織單位有合格的IRB中心,依據條款不能向其他IRB組織單位申請審查。
- 若您的研究案須要在不同的醫院收案,則需送審多家醫院的IRB,經通過各家審查後,才能分別在各家醫院執行收案。
- 若您不確定研究參與者的實際對象,建議可以提高一些研究參與者樣本數,避免後續研究執行時,招募超過預期的研究參與者數目,需要再變更IRB案件。
- 研究計劃案結束後,記得需要繳交結案報告唷!

封面圖-500x383.png)


